Zunächst einmal gehe ich davon aus, dass du alle Hilfen in Anspruch genommen hast wenn du hier gelandet bist. Ich werde auf einige dieser Hilfen hier zurück greifen.
Aufgabe 1) Salpetersäure ist eine starke Säure, das bedeutet, dass jedes Salpetersäure-Molekül im Wasser ein Proton abgibt und somit ein Oxonium-Ion bildet. Man gibt nun 0,5ml dieser Salpetersäure in 2000ml destiliertes Wasser. Das Volumen verändert sich nach der Zugabe nicht und bleibt bei 2000ml.
Berechne die Konzentration der Oxonium-Ionen in der Lösung in mol/L.
Zunächst einmal schauen wir welche Informationen wir aus der Aufgabenstellung herauslesen können.
- Bei der Säure handelt es sich um Salpetersäure
- das Volumen der Säure beträgt 0,5ml
- das gesamte Volumen beträgt 2000ml
Als nächstes schauen wir uns an wie man die Konzentration berechnet und welche Größen wir dafür brauchen.
- Die Einheit der Konzentration ist
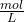 .
.
Allgemein gilt für die Konzentration ![]() .
.
In Worten bedeutet das:
Die Konzentration ist der Quotient aus Stoffmenge und Volumen.
Einfacher ausgedrückt, um die Konzentration zu berechnen muss man die Stoffmenge in Mol durch das Volumen in Litern teilen.
Das Volumen der gesamten Lösung kennen wir, es bleibt unverändert bei 2000ml also 2l.
Wir haben also schon unseren ersten Wert für die Berechnung der Konzentration.
![]() .
.
Es fehlt also noch die Stoffmenge der Oxonium Ionen.
Da jedes Salpetermolekül ein Proton abgibt und somit ein Oxonium-Ion erzeugt können wir die Stoffmenge von Salpetersäure und Oxonium Ionen gleich setzen.
![]()
Bekannt ist aber nur das Volumen der Salpetersäure. Dies beträgt 0,5ml.
Um aus dem Volumen an die Stoffmenge zu kommen berechnen wir zunächst aus dem Volumen die Masse der Salpetersäure.
Der Zusammenhang zwischen Dichte, Masse und Volumen lautet wie folgt.
![]()
oder mit Formelzeichen
![]()
Eventuell erinnerst du dich an das kleine Dreieck aus den Hilfekarten
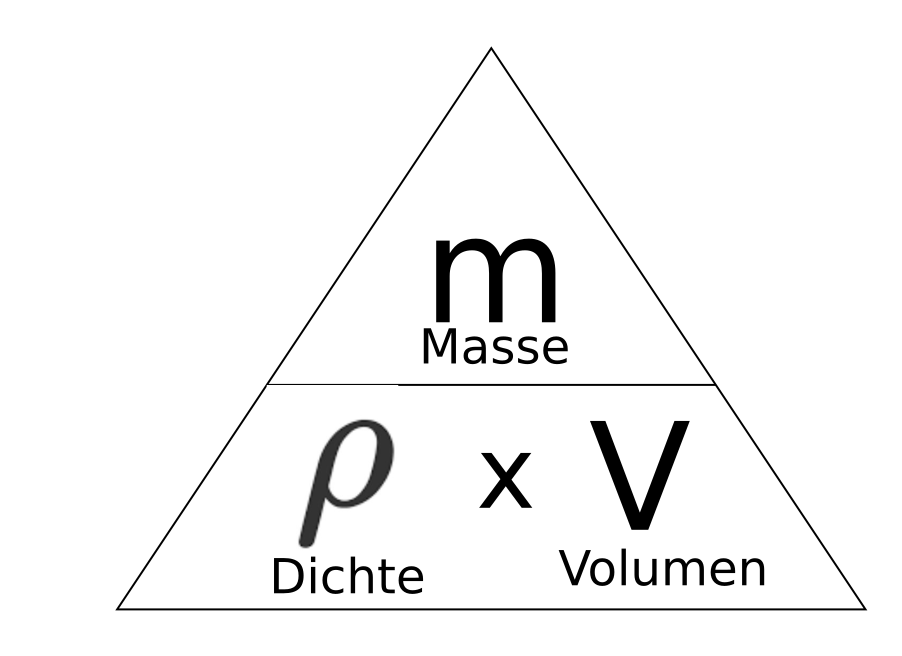
In unserem Fall möchten wir die Masse berechnen. Wir decken die Masse also ab und bekommen folgende Formel die man auch durch normales umformen erhalten kann.
![]()
Zur Berechnung der Masse fehlt uns jetzt die Dichte der Salpetersäure. Diese kann man schnell online finden oder im Buch auf Seite 209.
Salpetersäure hat eine Dichte von ![]()
In der Einheit der Dichte steht allerdings nun ![]() (Kubikzentimer) und wir haben das Volumen der Salpetersäure in
(Kubikzentimer) und wir haben das Volumen der Salpetersäure in ![]() .
.
Folgender Umstand erleichtert die Rechnung nun enorm
![]()
Ein Kubikzentimeter entspricht einem Milliliter.
Wir können nun also die Werte in die Formel einsetzten
![]()
![]()
Die Einheiten der Volumina kürzen sich weg und als Einheit bleibt die Masse in Gramm übrig.
![]()
Die Masse der Salpetersäure in den 2l Wasser beträgt also 0,755g.
Nun brauchen wir aber für die Berechnung der Stoffmengenonzentration eben die Stoffmenge und nicht die Massse.
Um die Stoffmenge in Mol zu berechnen die 0,755g Salpetersäure ergeben braucht man die Molare Masse der Salpetersäure. Diese kann man entweder selber berechnen indem man die Masse der einzelnen Atome summiert, oder man schaut die wieder online nach.
Salpetersäure hat eine Molare Masse von ![]()
Dies bedeutet, dass 1 Mol Salpetersäure eine Masse von 63,01g besitzt.
![]()
Wir wollen nun wissen wie viel Mol Salpetersäure 0,755g entsprechen.
Wir formen dazu zunächst die allgemeine Formel für die Molare Masse um:
![]()
- M ist die Molare Masse (in diesem Fall
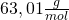 )
) - m ist die Masse (in diesem Fall
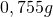 )
) - n ist die Stoffmenge in Mol die wir berechnen wollen
Stellt man die Formel nach n um, so ergibt sich folgender Zusammenhang:
![]()
Wir müssen also einfach die Masse (![]() ) durch die Molare Masse (
) durch die Molare Masse (![]() ) teilen um die Stoffmenge zu erhalten
) teilen um die Stoffmenge zu erhalten
![]()
![]()
![]()
Den Doppelbruch können wir lösen indem wir den Zähler mit dem Kehrwert des Nenners multiplizieren.
![]()
Nun haben wir die Stoffmenge die wir benötigen um die Konzentration zu berechnen.
![]() .
.
mit ![]() und
und ![]()
![]() .
.
Daraus folgt:
![]() .
.
Die Konzentration der Oxonium-Ionen beträgt also ungefähr ![]() .
.
Ich hoffe dir hat diese doch sehr kleinschrittige Rechnung geholfen.
Um etwas Übung zu bekommen, rechne die gleiche Aufgabe nochmal, allerdings mit 0,3ml Salpetersäure und 1200ml Wasser. Lade die Rechnung wenn du magst in dem folgenden Formular hoch.